0
0

Изучение методов повышения эффективности лучевого лечения местнораспространенного немелкоклеточного рака лёгкого
№ 4 - 2012 г.
14.00.00 медицинские и фармацевтические науки
УДК 616.24-006:615.849.114
О.Ю. Аникеева1,2, Е.А. Самойлова1, П.М. Иванов1, П.В. Филатов1, А.С. Кудрявцев1
1 ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н.Мешалкина» Минздравсоцразвития (г. Новосибирск)
2 ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздравсоцразвития (г. Новосибирск)
Изучены методы повышения эффективности лучевого лечения при немелкоклеточном раке легкого. Пролечено 34 пациента с IIb–IIIb стадиями, основной группе проведена лучевая терапия с контролем по дыханию на фоне физической и лекарственной радиомодификации, контрольной группе – лучевая терапия на свободном дыхании. В основной группе частичный регресс достигнут у 11-ти больных (58 %), стабилизация – шести (31,5 %), прогрессирование – двух (10,5 %). В группе контроля частичный регресс у пяти пациентов (33%), стабилизация – четырех (27 %), прогрессирование – шести (40 %). Таким образом, применение полирадиомодификаторов и системы контроля дыхания улучшает результаты лучевой терапии без повышения токсичности лечения.
Ключевые слова: онкотермия; стереотаксическая конформная лучевая терапия; рак легкого; активный контроль дыхания пациента.
Авторы научной публикации
Аникеева Ольга Юрьевна — кандидат медицинских наук, заведующая отделением радиотерапии ННИИПК им. акад. Е.Н. Мешалкина; ассистент кафедры онкологии ГБОУ ВПО НГМУ, контактный телефон: 8 (383) 333-14-70, e-mail: o_anikeeva@nricp.ru
Самойлова Елена Анатольевна — кандидат медицинских наук, врач-радиолог отделения радиотерапии ННИИПК им. акад. Е.Н. Мешалкина, контактный телефон: 8 (383) 333-14-70, e-mail: e_samoylova@nricp.ru
Кудрявцев Александр Сергеевич — врач-онколог, торакальный хирург отделения радиотерапии ННИИПК им. акад. Е.Н. Мешалкина, контактный телефон: 8 (383) 333-14-70, e-mail: a_kudrjavtsev@nricp.ru
Иванов Петр Михайлович — медицинский физик отделения радиотерапии ННИИПК им. акад. Е.Н. Мешалкина, контактный телефон: 8 (383) 333-14-70, e-mail: p_ivanov@nricp.ru
Филатов Петр Валерьевич — медицинский физик отделения радиотерапии ННИИПК им. акад. Е.Н. Мешалкина, контактный телефон: 8 (383) 333-14-70, e-mail: p_filatov@nricp.ru
Исходные данные исследования
Введение. Несмотря на существенно возросший уровень и совершенствование хирургической техники, большинство больных раком легкого к моменту установления диагноза, в силу распространенности опухолевого процесса или серьезных сопутствующих заболеваний, являются неоперабельными [1, 3]. В этой связи лучевая терапия остается основным методом лечения больных с местнораспространенными формами немелкоклеточного рака легкого (НМРЛ). В настоящее время в мире нет эффективных стандартов лечения и прогноз для пациентов, получающих лучевую терапию в связи с НМРЛ, остается неудовлетворительным [2]. Распространенность заболевания, экскурсия легких при дыхании, погрешности в воспроизводимости укладок заставляют выбирать широкие поля, с вовлечением в объем облучения большого массива здоровых тканей. При таких условиях подведение канцерицидной дозы лимитировано риском развития острых лучевых повреждений легких и сердца [3, 4]. На протяжении нескольких десятилетий стремление к повышению эффективности лучевой терапии вообще и рака легкого в частности заключается в поиске методов и средств (разработка аппаратов и применение новых режимов фракционирования дозы, радиосенсибилизаторов), обеспечивающих селективное усиление повреждения опухолевой ткани и снижение радиопоражаемости нормальных тканей, т. е. в расширении так называемого терапевтического интервала [2, 5–8].
Цель исследования: изучение методов повышения эффективности лучевого лечения распространенного немелкоклеточного рака легких у больных со сниженными компенсаторными возможностями.
Материалы и методы. С 2011 года в «Центре радиохирургии и лучевой терапии» ФГУ ННИИПК им. акад. Е. Н. Мешалкина было проведено лечение 34-х пациентов с диагнозом НМРЛ. Всем пациентам, поступившим для проведения лучевой терапии, было отказано в альтернативных методах лечения (низкие функциональные резервы, сопутствующие заболевания). Распределение по морфологическому критерию представлено следующим образом: плоскоклеточный ороговевающий рак – 6 пациентов; плоскоклеточный неороговевающий рак – 18 пациентов; аденокарцинома– 10 пациентов;
В исследовании приняли участие 8 женщин и 24 мужчины. Медиана возраста пациентов составила 62 года (от 42 до 80 лет). Усредненные размеры облучаемого объема у всех пациентов составили 10,2 см (интервал составил 4,8–15,0 см). У 12-ти пациентов имелось сдавление магистральных сосудов средостения, в пяти случаях – прорастание опухоли в перикард, у 22-х пациентов была различной степени выраженности сопутствующая сердечнососудистая патология.
Были сформированы две группы сравнения с учетом использования различных методов лечения. В 1-ю группу (основная) включено 19 (55,8 %) пациентов, получавших лучевое лечение с контролем по дыханию (АВС – Аctive Breathing Cordinator) на фоне разнонаправленных методов радиомодификации (лекарственный, физический). Вторую группу (контрольная) составили 15 (44,2 %) пациентов, получавших только конформную дистанционную лучевую терапию на свободном дыхании.
Во всех случаях было получено информированное согласие на проведение данного вида лечения.
Группировка пациентов
В сравниваемые группы больные включались согласно следующим критериям:
- наличие морфологически подтвержденного рака;
- стадия болезни III А–В, согласно седьмому изданию TNM классификации;
- отсутствие в анамнезе какого-либо лечения по поводу рака легких;
- активность по шкале Карновского не менее 60 %;
- абсолютное число лейкоцитов > 2000 в см3; тромбоцитов > 100 000 в см3, гемоглобина > 100 мг / %, креатинина < 130 моль / м3;
- в исследование допускались пациенты с тяжелой сопутствующей патологией, корригируемой лекарственными средствами (нестабильная стенокардия, нарушения ритма сердца, острыми нарушениями коронарного и/или мозгового кровообращения в анамнезе и т.д.).
Обе группы являлись статистически идентичными по сравниваемым параметрам (стадия заболевания, локализация поражения, вовлеченность лимфатических узлов средостения). Для исследования был разработан протокол обследования и лечения. Согласно протоколу, перед началом лучевой терапии пациентам проводилось следующее обследование:
- исследование стандартных общеклинических и биохимических показателей;
- МСКТ органов грудной клетки с внутривенным контрастированием;
- МРТ головного мозга;
- исследование показателей гемостаза;
- исследование показателей сердечнососудистой системы (ЭКГ; ЭХОКГ; Холтеровское мониторирование) с последующей консультацией кардиолога.
Проведение исследования
На этапе предлучевой подготовки выполнялось МСКТ топометрическое исследование с контрастным усилением на 16-срезовом сканере Toshiba LB. Топометрические снимки делались в аксиальной плоскости с толщиной среза не более 2 мм, угол наклона гантри 0°. Оконтуривание и совмещение изображений проводились на станции оконтуривания Focal Pro. Контуры GTV были очерчены согласно данных визуализации. Для CTV использовались стандартные отступы 0,7 см для плоскоклеточного рака и 0,8 см для аденокарциномы [9]. Учитывая минимальные смещения облучаемой мишени, отступы PTV в группе исследования составили 0,5 см. В группе сравнения отступы для PTV просчитывались индивидуально в результате совмещения трех серий изображений: МСКТ на свободном дыхании, на максимальном вдохе и максимальном выдохе.
Расчет лечебного плана осуществлялся на планирующей системе Ergo++. Режим и объем облучения определялись с учетом стадии заболевания, вовлеченности лимфатических узлов, расположения критических органов, тяжести сопутствующей сердечнососудистой патологии.
Для лечения использовался фотонный пучок с энергией от 6 до 10 МэВ, генерируемые на линейном ускорителе «Elekta Axesse». Лучевая терапия проводилась в режиме 5 раз в неделю, с облучением опухолевого очага, лимфатических узлов корня пораженного легкого и средостения с разовой очаговой дозой (РОД) 2,75 Гр до изоэквивалентной суммарной очаговой дозой (СОД) 70 Гр на очаг и СОД 50 Гр на лимфоузлы с покрытием 95 % изодозой объема PTV. При лечении использована методика ротационного объемно-
модулированного облучения VMAT (Volumetric Modulated Arc Therapy) с визуальным контролем по изображению IGRT (Image Guided Radiotherapy). Данная технология реализуется посредством устройства объемной рентгеновской визуализации (XVI – X-Ray Volume Imaging), размещенного на консоли линейного ускорителя с совмещенным изоцентром.
Контроль облучения с синхронизацией по дыханию реализуется посредством системы АВС. Устройство состоит из турбинного спирометра и дисплеев, визуально воспроизводящих кривые дыхания. Система конфигурируется индивидуально под каждого пациента или процедуру с возможностью изменения порогового значения и длительности задержки дыхания. Во время всех манипуляций пациент контролирует работу системы посредством специального пульта с кнопкой. Использование ABC позволяет существенно уменьшить объемы лучевого воздействия на нормальные ткани [5, 8].
Настоящее исследование предусматривало поиск оптимального сочетания радиомодификаторов, обеспечивающих селективное усиление повреждения опухолевой ткани и снижение радиопоражаемости нормальных тканей. Предполагалось, что эффективность лучевой терапии может быть повышена за счет приема химиопрепаратов в радиомодификационных дозах [2, 5, 8]. В нашем исследовании в качестве лекарственного радиомодификатора использовался препарат цисплатин с адекватной пре- и постгидратацией в дозе 40 мг/м2 1 раз в неделю № 6 внутривенно капельно. Курсовая доза составила 240 мг/м2.
Одной из задач исследования было повышение радиочувствительности опухолевых клеток посредством применения локальной гипертермии. Локальная гипертермия (электротермия), как метод физической радиомодификации, проводилась на аппарате EHY 2000 до сеанса лучевой терапии 3 раза в неделю в течение 90 мин с достижением эквивалентной температуры Т = 42,5 °С. Устройство EHY 2000 работает на радиочастоте 13,56 МГц и основана на принципе емкостного сопряжения, когда тело пациента выполняет функцию диэлектрика между пластинами конденсатора, роль которых играют электроды. Переменное электрическое поле, возникающее между электродами, автоматически концентрируется в опухолевых тканях ввиду их повышенной электропроводности, избирательно нагревая опухоль (эффект самофокусировки). Главное отличие используемой технологии электротермии на базе устройства EHY 2000 в противоположность классической локальной гипертермии заключается в дополнительном запуске механизма апоптоза раковых клеток вследствие деполяризации клеточных мембран, благодаря воздействию электрических полей [10].
В процессе лечения оценивалась динамика клинических проявлений, таких как уменьшение одышки, кровохарканья, анализировались побочные реакции, изменение размеров первичной опухоли на фоне проводимой лучевой терапии, степень выраженности ответа опухоли на облучение (полный, частичный, стабилизация болезни, прогрессирование). МСКТ-контроль локального статуса осуществлялся после СОД 50 Гр; через месяц и каждые 3 месяца после окончания лечения в течение всего периода наблюдения.
Результаты исследования
Результаты. Анализировались промежуточные результаты исследования 34-х пациентов с местно-распространенным НМРЛ. Медиана времени наблюдения от момента проведения лучевой терапии составила 10 месяцев. Оценивая результаты лечения, было отмечено, что в основной группе купирование симптомов заболевания, (кашель, одышка, боль в грудной клетке и т.д.) происходило на 10–12 дней раньше, чем в контрольной группе. Лучевые реакции проявлялись в виде эзофагита легкой степени тяжести, что позволяло провести курс лечения без расщепления до запланированной канцерицидной дозы. Средняя суммарная доза облучения при проведении самостоятельного курса по радикальной программе лучевой терапии была увеличена до значения 70 ± 4,0 Гр при условии, что максимальная эквивалентная СОД не превышала значения 80 Гр. Необходимо отметить, что возможность максимального увеличения СОД выше 74 Гр ограничивалась объемом пораженного органа и при объеме выше 500 см3 напрямую влияло на более высокую токсичность легкого или близко прилегающих критических структур. В случаях, когда опухоль расположена в непосредственной близости от корня легкого, в первую очередь, следует обращать внимание на лучевую нагрузку медиастинального отдела. На рисунке 1 представлен результат лечения больного раком легкого, до и после проведенного курса конформной дистанционной лучевой терапии по радикальной программе СОД = 70 Гр (рис. 2).
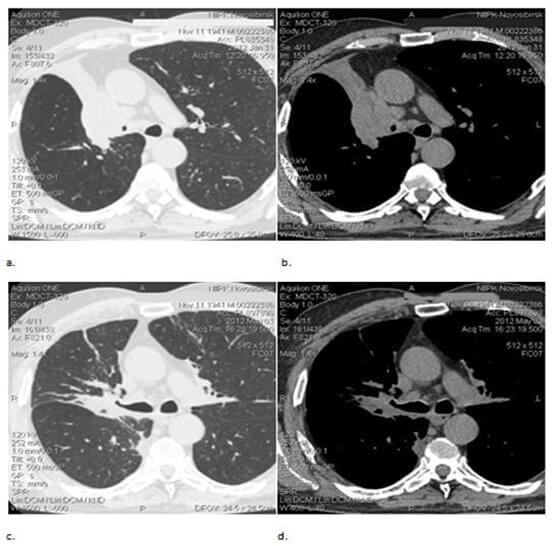
Рис. 1. Пациент Б., 71 год. Плоскоклеточный неороговевающий центральный рак верхней доли правого легкого T2N2M0 до начала лучевой терапии (a – легочное окно, b – мягкотканое окно); состояние через 3 месяца после окончания лучевой терапии (c – легочное окно, d – мягкотканое окно)
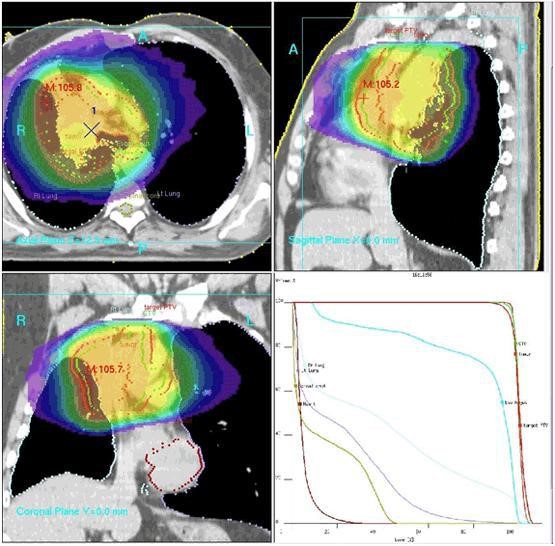
Рис. 2. Пациент Б., 71 год, 3-мерное изодозное распределение пациента и гистограмма доза-объем. Дозиметрический план выполнен по методике VMAT
Увеличение СОД выше 66 Гр в группе контроля сопровождалось более выраженными реакциями со стороны пищевода и легких. Клинически это выражалось болями при глотании, усилением кашля, плохо поддающимися симптоматической терапии, что лимитировало дальнейшую эскалацию суммарной очаговой дозы. При оценке эффективности лечения основной группы пациентов частичный регресс опухоли достигнут у 11-ти больных (58 %), стабилизация – у шести (31,5 %), прогрессирование болезни – у двух (10,5 %). Медиана времени до прогрессирования составила 9 месяцев. Медиана выживаемости пациентов не достигнута.
При оценке эффективности конформной дистанционной лучевой терапии в группе контроля (без применения полирадиомодификаторов) частичный регресс опухоли достигнут у пяти пациентов (33 %), стабилизация болезни – у четырех (27 %), прогрессирование опухолевого процесса – у шести (40 %). Медиана времени до прогрессирования составила 4 месяца. Медиана выживаемости пациентов 7 месяцев.
Использование устройства активного контроля дыхания позволяет существенно сократить объем облученной здоровой ткани легкого, уменьшить клинические отступы, снизить лучевые реакции, соответственно увеличивая суммарную очаговую дозу за курс лечения и значительно увеличить эффективность локального контроля над опухолью. Соблюдая одинаковые подходы при выполнении совмещения изображения МСКТ и системы визуализации на ускорителе при активном контроле дыхания (АВС) позволяет значительно снизить процент системной ошибки при укладке, улучшая ее воспроизводимость. Из недостатков данной системы надо отметить более длительную предлучевую подготовку пациента. Само облучение занимает большее количество времени, снижая пропускную способность. Требуется обязательная высокая квалификация персонала.
Итоги исследования
Выводы. Таким образом, использование методик с контролем облучения по дыханию на фоне применения комплекса разнонаправленных радиомодификаторов позволяет улучшить результаты конформной лучевой терапии больных с местно-распространенным НМРЛ без повышения токсичности лечения.
Список литературы
- Пасов В. В. Поздние лучевые повреждения органов грудной клетки / В. В. Пасов, Н. Д. Зубова, Е. М. Иволгин // Сиб. онкол. журн. – 2009. – № 6. – С. 58–61.
- Чисов В. И. Онкология : национальное руководство / В. И. Чисов. – М. : ГЭОТАР-Медиа, 2008.
- A new method of classifying prognostic co morbidity in longitudinal studies: development and validation / M. E. Charlson [et al.] // J. Chronic. Dis. – 1987. – N 40. – С. 373–383.
- The effect of breathing and set-up errors on the cumulative dose to a lung tumor / M. Engelsman [et al.] // Radiotherapy and Oncology. – 2001. – N 60. – С. 95–105.
- Escalation and intensification of radiotherapy for Stage III non-small cell lung cancer: opportunities for treatment improvement / J. D. Fenwick [et al.] // Clin. Oncol. – 2009. – doi:10.1016/j.clon.2008.12.0 1.
- Advances in Radiation Oncology in Lung Cancer / B. Jeremic [et al.] – Second edition – Springer, 2011
- High-dose radiation improved local tumor control and overall survival in patients with inoperable/unrespectable non-small-cell lung cancer: long-term results of a radiation dose escalation study / F. M. Kong [et al.] // Int. J. Radiat. Oncol. Biol. Phys. – 2005. – N 63. – С. 324–333.
- Defining the margins in the radical radiotherapy of non-small cell lung cancer (NSCLC) with active breathing control (ABC) and the effect on physical lung parameters / N. Panakis [et al.] // Radiotherapy and Oncology. – 2008. – N 87. –C. 65–73.
- Dose-effect relations for early local pulmonary injury after irradiation for malignant lymphoma and breast cancer / J.C. Theuws [et al.] // Radiotherapy and Oncology. – 1998. – N 48. – С. 33–43.
- Radiation dose prescription for non-small-cell lung cancer according to normal tissue dose constraints: an in silico clinical trial / A. Van Baardwijk [et al.] // Int. J. Radiat. Oncol. Biol. Phys. – 2008. – N 71. – С. 1103–1110.