0
0

Трехмерная верификация дозиметрических планов при радиохирургии злокачественных новообразований в легком
№ 5 - 2012 г.
14.00.00 медицинские и фармацевтические науки
УДК 616.24-006:615.849-089
О.Ю. Аникеева1,2, О.А. Пашковская1, П.В. Филатов1, И.В. Бедный1, Е.С. Половников1,2
1ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина» Минздравсоцразвития РФ (г. Новосибирск)
2ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздравсоцразвития (г. Новосибирск)
В работе исследовались расчетные планы 10-ти пациентов, которым было проведено лечение опухолей легкого и метастазов в легкое. Осуществлялась проверка лечебных планов, выполненных методом ротационного объемно-модулированного облучения (VMAT). Лечение проводилось в режиме одно- либо трехкратного облучения дозой 15–20 Гр за фракцию. Процедуры выполнялись на ускорителе Elekta Axesse, оснащенном устройством EPID. Верификация планов выполнялась при помощи устройства EPID и программного обеспечения DosimetryCheck. Среднее отклонение дозы в изоцентре для расчетных и измеренных планов составило 1,23 %. Трехмерный γ-анализ показал γсред = 0,3 ± 0,02, γmax = 1,10 ± 0,12 и объем PTV с γ ≤ 1 равный 97,95 %.
Ключевые слова: радиохирургия; портальная дозиметрия; рак легкого; метастазы в легком; контроль дыхания пациента.
Авторы научной публикации
Аникеева Ольга Юрьевна — кандидат медицинских наук, заведующая отделением радиотерапии ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина», ассистент кафедры онкологии ГБОУ ВПО «Новосибирский государственный медицинский университет», рабочий телефон: 8 (383) 333-14-70, e-mail: o_anikeeva@nricp.ru
Пашковская Оксана Александровна — инженер ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина», рабочий телефон: 8 (383) 333-14-70, e-mail: oxana.pashkovskaya@gmail.com
Филатов Петр Валерьевич — медицинский физик отделения радиотерапии ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина», рабочий телефон: 8 (383) 333-14-70, e-mail: p_filatov@nricp.ru
Бедный Игорь Витальевич — медицинский физик отделения радиотерапии ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина», рабочий телефон: 8 (383) 333-14-70, e-mail: igor.bedny@nricp.ru
Половников Евгений Сергеевич — кандидат медицинских наук, врач-радиолог отделения радиотерапии ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина», ассистент кафедры онкологии ГБОУ ВПО «Новосибирский государственный медицинский университет», рабочий телефон: 8 (383) 333-14-70, e-mail: polovnikov@nricp.ru
Исходные данные исследования
Введение. Стереотаксическая радиохирургия — это прецизионное однократное подведение высоких доз ионизирующего излучения к небольшим патологическим образованиям обычно до 3 см. Этот метод лечения хорошо зарекомендовал себя при лечении опухолей и метастазов в легкое [3, 5]. Радиохирургия является неинвазивным методом лечения, не требует анестезии и госпитализации пациента.
Высокую конформность дозных распределений можно получить, применяя множество статических полей либо динамических арок [6]. Одной из таких методик является ротационное объемно-модулированное облучение (VMAT). VMAT представляет собой методику лечения с использованием одной или нескольких арок вращения гантри с постоянно изменяющейся апертурой коллиматора, скоростью движения гантри и интенсивностью отпускаемой дозы. VMAT позволяет существенно сократить время лечения, обеспечивая при этом высококонформное распределение дозы в облучаемом объекте [7, 8, 10].
Неотъемлемой частью обеспечения высокого качества лечения является дозиметрическая проверка расчетных планов [4]. Современные технологии в лучевой терапии, например, средства диагностики для определения объема мишени, 3D-системы планирования и новейшие ускорители могут применяться в полном объеме только при гарантии, что доза, получаемая пациентом, соотносится с расчетной. Согласно международным рекомендациям МАГАТЭ [1], ошибка в поглощенной дозе должна быть не более 5 %, что соответствует 2–3 % общей погрешности при одном стандартном отклонении.
Цель данной работы состоит в оценке возможности использования устройства портальной дозиметрии для трехмерной дозиметрической предтерапевтической верификации VMAT планов при радиохирургическом лечении опухолей и метастазов в легкое.
Материалы и методы. Для лечения пациентов используются два ускорителя Electa Axesse, оснащенные многолепестковым коллиматором Beam Modulator, а также рентгеновской системой объемного формирования изображений (XVI) и устройством получения портальных изображений (EPID).
Beam Modulator — многолепестковый коллиматор с апертурой 16 × 21 см2 и шириной лепестков 0,4 см. Коллиматор оснащен оптически позиционируемой системой, обеспечивающей прецизионное положение лепестков и высокую точность подведения дозы.
XVI или рентгеновский объемный визуализатор позволяет получать трехмерное объемное изображение анатомических структур непосредственно перед лечебной процедурой. Таким образом, можно скорректировать положение мишени с учетом смещения внутренних органов. Использование XVI снижает ошибки при укладке пациентов, что позволяет уменьшить допуски при планировании облучения.
Ускорители оснащены устройствами для получения портальных изображений (EPID) под названием iViewGT. Electa IViewGT — это визуализирующее устройство на основе аморфного кремния. Область регистрации составляет 41 × 41 см2, размер пикселя 0,25 мм. EPID обеспечивает «мегавольтное» изображение с высоким разрешением и контрастностью для верификации лечения, которое осуществляется непосредственно в лечебном пучке.
Для расчета дозных распределений используется система планирования ERGO++. ERGO++ позволяет планировать лечение статическими и динамическими полями, методикой VMAT, радиохирургическое лечение и осуществлять инверсное планирование. Оно обеспечивает оптимальное трехмерное распределение дозы облучения с учетом индивидуальных особенностей пациента.
В качестве дополнительной системы позиционирования мишени для всех рассматриваемых пациентов использовалась система ABC (система контроля дыхания пациента). Метод заключается в том, что пациент делает глубокий вдох или выдох на определенный объем и установленное количество секунд. Облучение и визуализация положения пациента происходит только во время задержки дыхания. Метод предполагает, что при одинаковых глубоких вдохах или выдохах очаг будет находиться в определенном и воспроизводимом положении. Это позволило существенно сократить отступы от CTV, связанные c возможным сдвигом мишени, которые для легкого являются определяющими при выборе объема облучения.
Проведение исследования
Проверка заключалась в выполнении облучения EPID панели по рассчитанному лечебному плану. Во время движения гантри его положение измерялось при помощи инклинометра. Полученные изображения сравнивались с расчетными планами программой DosimetryCheck [2].
На первом этапе фиксировались изображения на EPID панели. Для определения интенсивности в каждой точке в единицах дозы проводилась калибровка EPID панели.
С этой целью перед каждой проверкой облучалось поле 10,4 × 10,4 см2 с дозой в 100 МЕ. Затем выполнялась обратная реконструкция дозных распределений.
Результаты. Были проанализированы 10 планов радиохирургического облучения при опухолях (метастазах) в легком, выполненные методом VMAT. В табл. 1 показан обзор верифицированных планов.
Таблица 1
Обзор верификационных планов
| Локализация |
Средний объем PTV, см3 |
Максимальный диаметр PTV, см |
Доза, сГр |
Энергия, МэВ |
Точность в изоцентре, % |
Число исследуемых планов |
|---|---|---|---|---|---|---|
| SRS опухоль легкого |
16,0 |
2,1 |
1500, 1800 |
6 |
1,36 |
4 |
| RS метастаза в легкое |
11,7 |
1,8 |
2000 |
6 |
1,10 |
6 |
- Верификация дозы в изоцентре. На первом этапе была выполнена проверка по совпадению дозы в изоцентре. Сравнения дозы в точке показали, что значения, полученные на EPID панели и вычисленные при планировании, хорошо согласуются.
Среднее отклонение составило 1,23 % (интервал 1,02–1,90 %). Данный результат отлично согласуется с протоколами, рекомендуемыми МАГАТЭ. - Двумерная верификация:
- сравнение профилей;
- сравнение изодозных кривых.
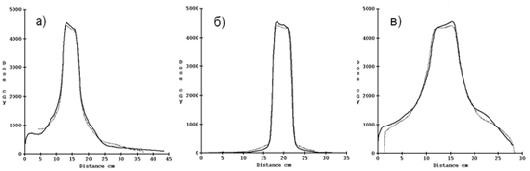
Рис. 1. Сравнение профиля вдоль оси а) Х, б) Y, в) Z, проходящей через изоцентр.
Сплошной линией показана измеренная доза, точками — расчетная.
На рис. 1 видно хорошее совпадение в пределах мишени. На рис. 2 показан пример сравнения изодозных кривых для 70, 80, 95 и 100 %. Зеленым цветом показаны планируемые изодозные линии, пурпурным — рассчитанные программой DosimetryCheck.
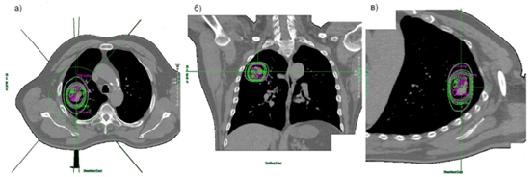
Рис. 2. Сравнение изодозных кривых а) в трансверсальной, б) корональной, в) саггитальной проекциях. Показаны изодозы: 70, 80, 95 и 100 %. Зеленым цветом обозначены планируемые изодозы, пурпурным — рассчитанные программой DosimetryCheck
Рис. 2 демонстрирует хорошее совпадение изодозных кривых. Небольшие отклонения кривых объясняются различием алгоритмов вычисления дозы для системы планирования и программы реконструкции, а также аппаратными ошибками ускорителя и EPID панели.
- γ-анализ.
Пример гистограмм γ-индекс/объем показан на рис. 3. Это распределение демонстрирует, что 100 % точек в исследуемом объеме имеет γ-индекс ≤ 1. Для 3-мерного γ-анализа γ ≤ 1 означает, что измеренная доза в точке либо согласуется в пределах 3 % с рассчитанной дозой, либо в пределах 3 мм есть точка с такой дозой.

Рис. 3. Распределение γ-индекс/объем. Черным цветом показано распределение для контура: а) PTV, б) CTV, в) спинной мозг, красным обозначаются области, где доза выше планируемой, голубым — ниже. Используется критерий 3 %, 3 мм, объема для вычисления γ-индекса на уровне 50 % изодозы
В табл. 2 показаны средние значения объема PTV с γ ≤ 1, γсред и γmax со стандартными отклонениями для исследуемых локализаций всей статистики пациентов.
Таблица 2
Результаты γ-анализа
| Локализация |
% объема PTV с γ ≤ 1 P% |
γсред |
γmax |
|---|---|---|---|
| SRS опухоли легкого |
97,2 ± 1,5 |
0,32 ± 0,03 |
1,12 ± 0,14 |
| SRS метастаза в легкое |
98,7 ± 1,1 |
0,28 ± 0,02 |
1,09 ± 0,11 |
Измеренные параметры позволили оценить хорошее качество дозиметрических распределений, полученных при помощи EPID панели, и сделать вывод о совпадении реальной дозы, отпускаемой ускорителем, с планируемой в пределах погрешностей, рекомендованных МАГАТЭ.
Результаты исследования
Обсуждение. Результаты работы демонстрируют возможность использования EPID панели для верификации VMAT планов радиохирургического облучения опухолей и метастазов в легком малого размера (менее 3 см). Данный метод позволяет оценить реальную дозу, отпускаемую ускорителем. Рассмотренный в работе способ верификации используется в нашем центре в качестве предтерапевтической проверки, так как имеет существенное преимущество по времени в сравнении с проверкой планов на фантоме и дозиметрических пленках.
Были проанализированы 10 планов облучения пациентов. Среднее отклонение дозы в изоцентре для расчетного и измеренного с помощью EPID панели планов составило 1,23 % (интервал 1,02–1,90 %). Трехмерный γ-анализ показал γсред = 0,30 ± 0,02, γmax = 1,10 ± 0,12 и объем PTV с γ ≤ 1 равный 97,95 %. Следующим этапом работы будет разработка метода in vivo дозиметрии для оценки дозы, получаемой пациентов в процессе лечения.
Список литературы
- Absorbed dose determination in external beam radiotherapy. An international code of practice for dosimetry on standards of absorbed dose to water. — 2000. — IAEA Report TRS-398 — International Atomic Energy Agency, Vienna, Austria.
- A dose delivery verification method for conventional and intensity-modulated radiation therapy using measured field fluence distributions / Wendell Dean Renner [et al.] // Medical Physics. — 2003. — N 30. — Р. 2996-3005.
- Advances in Radiation Oncology in Lung Cancer / B. Jeremic [et al.]. — Second edition. — Springer, 2011.
- Guidelines for the Verification of IMRT / Markus Alber [et al.]. — 2008. — Estro booklet, Brussels, Belgium.
- Hypofractionated stereotactic radiotherapy for medically inoperable stage I non-small cell lung cancer — report on clinical outcome and dose to critical organs / W.Y. Ng Alice [et al.] // Radiotherapy and Oncology. — 2008. — N 87. — Р. 24–28.
- Prescribing, recording and reporting : The International commission on radiation units and measurements. — 2010. — ICRU report N 83 : ICRU, Washington DC, USA.
- RapidArc volumetric modulated therapy planning for prostate cancer patients / F. Kjaer-Kristoffersen [et al.] // Acta Oncol. — 2009. — N 48. — Р. 227–232.
- Treatment of lung cancer using volumetric modulated arc therapy and image guidance. A case study / J. L. Bedford [et al.] // Acta Oncol. — 2008. — N 47. — Р. 1438–1443.
- Rapid delivery of stereotactic radiotherapy for peripheral lung tumors using volumetric intensity-modulated arcs / W. F. Verbakel [et al.] // Radiotherapy and Oncology. — 2009. — N 93. — Р. 122–124.
- Volumetric intensity-modulated arc therapy vs. conventional IMRT in head and-neck cancer : a comparative planning and dosimetric study / W. F. Verbakel [et al.] // Int. J. Radiat. Oncol. Biol. Phys. — 2009. — N 74. — Р. 252–259.

Запишитесь на профилактический прием и получите ответ на волнующие вас вопросы о состоянии вашего здоровья.
Получить консультацию можно по номеру +7 (495) 153-49-30