0
0

Стереотаксическая конформная лучевая терапия злокачественных опухолей лёгкого у больных с сердечнососудистой патологией
Аникеева О.Ю., Половников Е.С., Бедный И.В., Филатов П.В.
ФГБУ Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина Минздрава России, Новосибирск, Россия
Контакты: Аникеева О.Ю. E-mail: sibradiolog@list.ru, o_anikeeva@nrisp.ru
Представлены результаты применения технологии стереотаксической лучевой терапии с использованием системы активного контроля дыхания у больных немелкоклеточным раком лёгкого с конкурирующей сердечнососудистой патологией.
Материалы и методы. 26 больным немелкоклеточным раком лёгкого с сопутствующей сердечнососудистой патологией, получавшим лечение в отделении радиотерапии ННИИПК им. акад. Е.Н. Мешалкина в период с сентября 2010 по март 2012 гг., проведена стереотаксическая конформная лучевая терапия. Медиана возраста составила 67 лет, диапазон – от 48 до 80 лет, соотношение мужчин и женщин было 3:1. 83% пациентов имели верифицированный гистологический диагноз. Средний диаметр опухоли – 6±2,8 см, преимущественно центральные формы (61%), IIB-IIIА стадия, ДН не превышала II ст. Все больные имели серьезную конкурирующую сердечно-сосудистую патологию различной степени выраженности.
Проведение лучевой терапии осуществлялось на стереотаксическом линейном ускорителе. Протокол предлучевой подготовки включал МCКТ топометрическое исследование, оконтуривание и совмещение изображений проводили на станции оконтуривания Focal Pro, расчёт лечебного плана – на планирующей системе Ergo++. Использовали различные устройства для фиксации пациентов, систему контроля по изображению (IGRT). Лечение проводили с использованием активного контроля за дыханием (ABC), при умеренном вдохе с задержкой дыхания в среднем 15-18’, ротационным объёмно-модулированным облучением.
Результаты. Отмечено достоверное увеличение средней суммарной дозы облучения при самостоятельной радикальной программе лучевой терапии (70+4 Гр) с использованием АВС. Это было связано с более часто встречающимися центральными формами немелкоклеточного рака и увеличением среднего уровня толерантности критических органов (пищевод, средостение, сердце, спинной мозг). Кроме того, использование АВС в 70% позволяет проводить лучевую терапию без расщепления курса, тем самым достоверно увеличивая эффективность локального контроля над опухолью. Анализ промежуточных результатов исследования показал, что у 66% больных признаки прогрессирования заболевания отсутствовали. У 15% через 18+3нед. отмечено появление прогрессирование заболевания, потребовавшее присоединения системной полихимиотерапии, у 12% констатировано метастатическое поражение противоположного легкого, потребовавшее повторного лучевого лечения.
Выводы. Использование системы активного контроля дыхания позволяет достичь увеличения общегообъёмалёгкихи, сокращая PTV, даетзначительное снижение средней токсичной дозы на легкое, а также на критические органы (пищевод, средостение, спинной мозг), увеличивая при этом суммарную поглощенную дозу, что ведет к значительному увеличению выживаемости пациентов с сердечно-сосудистой патологией.
Ключевые слова: стереотаксическая конформная лучевая терапия, радиотоксичность здоровых тканей, ранние и поздние лучевые осложнения, активный контроль за дыханием, коморбидная патология.
ВВЕДЕНИЕ
Сегодня рекомендуемым методом лечения немелкоклеточного рака лёгкого (НМРЛ) является хирургический, однако применить его удается не всегда [6, 19]. Конкурирующая тяжелая сердечнососудистая патология, функциональный статус, дыхательная функция и возраст часто становятся факторами, определяющими выбор метода лечения пациентов этой группы. К сожалению, стандартные критерии отбора таких больных для хирургического лечения отсутствуют [1, 14, 19]. Тем не менее, известно, что наиболее высокий риск развития инфаркта миокарда при резекции легких имеют больные с нестабильной или тяжелой формами стенокардии (III и IV функциональные классы), инфарктом миокарда давностью менее 30 суток, декомпенсированной сердечной недостаточностью, тяжелым поражением клапанного аппарата сердца [7, 10, 16]. Пациентов со сниженными легочными резервами или функциональным статусом, имеющих по причинам коморбидности высокие риски осложнений при оперативном вмешательстве, часто лечат радикальным облучением. Несмотря на то, что они имеют такие же клинические стадии, как и операбельные больные, у них отмечается худший прогноз, ограничивающий возможность сравнения методов лечения [15, 16, 19]. Смертность, не связанная с раком, дает различное процентное соотношение всех смертностей хирургического и лучевого лечения [19]. Кроме того, при использовании лучевого лечения опухолей грудной клетки существенны величина суммарной лучевой нагрузки на уже скомпрометированную конкурирующими заболеваниями сердечно-сосудистую систему и общий объем ткани средостения (при наличии дополнительных зон облучения) [3, 5, 6, 19]. Рак лёгкого по-прежнему остается наиболее распространенной формой онкологического заболевания, при которой оперативное вмешательство не превышает 20%, а резектабельность – 15% [1, 6, 7,15]. Ограниченная способность лучевой терапии осуществлять локальный контроль во многом обусловлена невысокой радиочувствительностью самой опухоли [15]. Прогноз при НМРЛ остаётся крайне неблагоприятным даже у пациентов, подлежащих радикальной лучевой терапии. Это связано тем, что распространенные стадии заболевания, экскурсия лёгких, точность укладки и регулярная воспроизводимость лечения заставляют выбирать широкие поля облучения, захватывающие большие объёмы тканей, в т. ч. здоровых. Риск развития острого лучевого повреждения лёгкого и средостения на фоне лучевой терапии напрямую зависит от дозы облучения и объёма нормальной ткани, подвергшейся облучению [4, 7, 9, 11, 12]. Одной из причин неуспеха лучевой терапии рака лёгкого является необходимость использования высоких дозх облучения для обеспечения локального контроля над опухолью [8] вследствие ее низкой радиобиологической чувствительности на фоне быстро развивающейся радиотоксичности окружающей нормальной ткани лёгкого [3, 9].
На сегодняшний день локальный контроль обеспечивают за счёт использования различных схем нестандартного фракционирования и увеличения суммарной поглощенной дозы, а также систем, позволяющих точно определять объём мишени во время лечения и, как следствие, сокращать объём облучения [9, 17, 20].
В данной работе представлены результаты стереотаксического конформного лучевого лечения при использовании системы активного контроля дыхания ABC (Аctive Breathing Coordinator) у больных c местно-распространенным раком легкого, дающие возможность оценить эффективность увеличения суммарной дозы на опухоль и влияние облучения на сердечно-сосудистую систему [11, 13, 17, 18].
МАТЕРИАЛЫ И МЕТОДЫ
Представлены данные о 26 пациентах, которым проводили лучевое лечение по поводу НМРЛ IIb стадии с использованием умеренного глубокого вдоха с последующей задержкой дыхания при помощи системы ABC. Всем пациентам после комплексного обследования проведена радикальная лучевая терапия. У 83% диагноз был гистологически верифицирован. У всех пациентов имелась серьезная конкурирующая сердечно-сосудистая патология. Большинство (16, или 64%) страдали ишемической болезнью сердца (ИБС), из них у 28% было вмешательство на сердце в объёме аортокоронарного шунтирования, у 72% – стентирования венечных артерий. У четырех пациентов этой группы стентирование было проведено более трех раз. 30% (8) пациентов имели тяжелые приобретенные пороки сердца, состояние после протезирования клапанов сердца, 46% (11) – нарушения ритма сердца различной степени выраженности (у трех пациентов – III степень выраженности сердечной недостаточности). Все пациенты были оперированы в клинике им. акад. Е.Н. Мешалкина в различные периоды конкурирующего заболевания. Медиана возраста составила 67 лет, диапазон от 48-80 лет, соотношение мужчин и женщин – 3:1. Средний диаметр опухоли – 6,0+2,4 см, преобладали центральные формы (61%), стадия рака легкого IIB-IIIА (90%), ДН не превышала II ст. Данным пациентам планировалась радикальная схема лучевого лечения. Был разработан протокол обследования и лечения. Стандартное обследование включало обязательную гистологическую верификацию и МСКТ лёгких с контрастированием на 32/64-срезовом томографе GE. Режим облучения и его объём определяли с учётом стадии заболевания, вовлеченности лимфатических узлов, расположения критических (здоровых) органов, тяжести соматической (сердечно-сосудистой) патологии.
Лучевую терапию осуществляли на стереотаксическом комплексе, на базе линейного ускорителя Elekta Axesse. Протокол предлучевой подготовки включал МCКТ топометрическое исследование, которое проводили на 16-ти срезовом МСКТ сканере Toshiba LB, в аксиальной плоскости, с толщиной среза не более 2 мм, Т1 взвешенное изображение с контрастным усилением (омнискан), угол наклона гентри 0 градусов. Оконтуривание и совмещение изображений проводили на станции оконтуривания Focal Pro, расчёт лечебного плана– на планирующей системе Ergo++.
В работе использовали различные устройства для фиксации пациентов, наличие системы контроля по изображению (IGRT) позволяло контролировать точность установки и воспроизведения укладок. Средняя суммарная доза составила 70-74 Гр, количество фракций зависело от режима фракционирования, доза за фракцию составляла от 2 до 4 Гр, с покрытием 95% изодозой объёма GTV. В охвате PTV стремились к максимально идентичным и сопоставимым планам, насколько это было возможно. Это наиболее трудная задача с учётом подвижности органа и его структурной неоднородности. Нагрузка на критические органы была сделана с учётом толерантности здоровых тканей. На этапе предлучевой подготовки были выполнены МСКТ в двух сериях на свободном дыхании и серия исследований при помощи системы ABC. GTV были очерчены согласно данных визуализации и предложенных атласов RTOG. В данной группе использовали стандартные рекомендованные отступы для CTV = 1,0 см вверх и вниз и 1,0 см в аксиальной плоскости. PTV соответственно составили в верхней и средней доле 0,5 см superior/ inferior, в нижней доле – 0,7 см superior/inferior, anterior/posterior = 0,5см, left/right = 0,5 см для всехдолей. Эти отступы были просчитаны в результате совмещения двух серий изображений МСКТ на свободном дыхании и при МСКТ при использовании ABC устройства. Было определено среднее значение подвижности лёгкого на фоне ABC. Облучение проводили методикой VMAT (Volumetric Modulated Arc Therapy) – ротационное объемномодулированное.
ABC устройство. Active Breathing Coordinator состоит из турбинного спирометра и дисплеев визуально воспроизводящих кривые дыхания. Чтобы повысить точность спирометрических измерений, у пациента, дышащего через трубку с бактериальным фильтром, зажимается нос. После прохождения через спирометр определенного объема воздуха (пороговое значение) управляемый дыхательный клапан перекрывает дыхательную трубку, помогая пациенту задерживать дыхание на одном и том же уровне. Система настраивается индивидуально под каждого пациента или процедуру с возможностью изменения порогового значения и длительности задержки дыхания. Во время манипуляций пациент контролирует работу системы посредством специального пульта с кнопкой. Эта кнопка должна быть нажата для нормального функционирования системы, и если она будет отпущена, клапан автоматический разблокируется, и пациент сможет свободно дышать. Обычно перед использованием требуется ознакомить пациента с возможностями системы. Для этого ещё перед съемкой на КТ пациент проходит обучение и тренировку. В этот же момент выбирается комфортное для данного пациента пороговое значение вдоха (или выдоха) и длительность удержания дыхания. Использование ABC лишь незначительно увеличивает время проведения процедуры и составляет в среднем примерно 15 мин.
Опубликованные данные показывают высокую клиническую эффективность системы и хорошую переносимость пациентами [11, 21]. Даже пациенты с нарушением дыхательных функций в состоянии обеспечить задержку дыхания на 15-20 сек. Главная цель, которой руководствовались создатели ABC, – ограничить респираторные колебания и, как результат, обеспечить более точную доставку дозы. При проведении КТ исследований стационарное положение опухоли увеличивает точность определения мишени [11, 15, 21]. Например, в случае опухолей, расположенных в нижних долях легких, это позволяет не только получать снимки лучшего качества, но и существенно сократить PTV, тем самым сохранив при лечении окружающие здоровые ткани [11, 21]. По существующим данным, при лечении печени с использованием ABC, амплитуда движения мишени сокращается с первоначальных 10-40 мм до 0-5 мм, что позволяет подводить к мишени существенно большие дозы при том же уровне риска осложнений. Высокая воспроизводимость положения мишеней и критических органов при использовании ABC во время одной сессии и между фракциями подтверждена многочисленными клиническими испытаниями. В некоторых случаях АВС снижает необходимость в частом использовании систем визуализации непосредственно в ходе лечения [8, 11, 21, 26].
РЕЗУЛЬТАТЫ
При анализе результатов лечения 26 пациентов, получавших лечение рака легкого с активным контролем дыхания, отмечено увеличение средней суммарной дозы облучения при проведении самостоятельной радикальной программы лучевой терапии (70+4,0 Гр). В исследовании не использовали увеличение эквивалентной СОД более 80 Гр. Это было связано с более часто встречающимися центральными формами НМРЛ и увеличением среднего уровня толерантности критических органов (пищевод, средостение, сердце, спинной мозг). Кроме того, использование АВС позволяет в 70% проводить лучевую терапию без расщепления курса, достоверно увеличивая тем самым эффективность локального контроля над опухолью. Необходимо отметить, что возможность максимального увеличения СОД выше 74 Гр ограничивалась объёмом пораженного органа. При расположении опухоли в непосредственной близости от корня легкого в первую очередь следует обращать внимание на лучевую нагрузку медиастинального отдела. Надо отметить, что у 22 (84,6%) пациентов не было выявлено значительных нарушений гемодинамики или декомпенсации сердечно-сосудистой системы, потребовавших прервать лечение. У 4 пациентов нарушения ритма и изменение гемодинамики носили обратимый характер и купировались приемом стандартных кардиотропных и гипотензивных препаратов. В 30% клинических наблюдений быстро нарастающая лучевая реакция со стороны пищевода (трудности при проглатывании пищи), прогрессирующий кашель, плохо поддающиеся симптоматической терапии, снижение числа лейкоцитов заставляло прекратить лечение и расщеплять курс. Надо отметить, что при большом объеме новообразования, вовлечении лимфатических узлов средостения контроль респираторного цикла в терминах лучевой нагрузки на критические органы не имеет значительных преимуществ перед конвенциальными конформными методиками. Поэтому в некоторых случаях вполне оправдано применение фиксированных полей облучения или методики IMRT на свободном дыхании пациента.
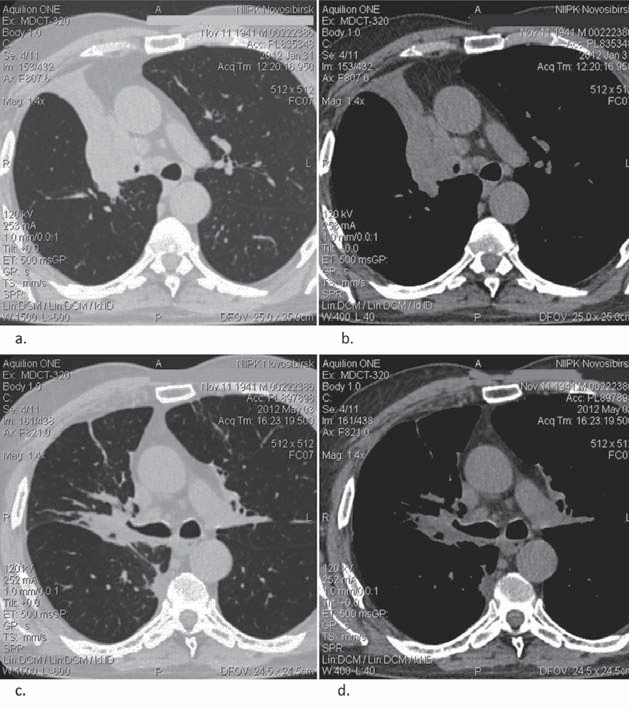
Рис. 1. Б-ой, 71 год. Центральный рак верхней доли правого лёгкого T2N2M0, плоскоклеточный неороговевающий: до начала лучевой терапии (a – легочное окно, b – мягкотканое окно); через 3 мес. после окончания лучевой терапии (c – легочное окно, d – мягкотканое окно).
Ситуация кардинально меняется при небольшой распространенности процесса или наличии отдельных очагов, когда требуется прецизионное облучение сразу нескольких мишеней. В таком случае альтернативы методу контролируемой задержки дыхания нет [21, 22].
На рисунке 1 представлен результат лечения больного раком легкого до и после проведенного курса стереотаксической конформной дистанционной лучевой терапии по радикальной программе в режиме динамического фракционирования СОД=70 Гр.
В таблице 1 приведены данные пациентов, получавших курс лучевой терапии по поводу первичного рака легкого в режиме РОД 2,75 Гр суммарно до 70 Гр с применением ABC.
Как видно из приведенных данных, преимущество VMAT с контролем по дыханию тем очевиднее, чем меньше объем облучаемой мишени. Это может стать определяющим фактором в выборе метода лечения для пациентов с сердечной патологией.
Таблица 1
| Лучевая нагрузка на органы средостения при облучении VMAT с использованием системы активного контроля дыхания |
|||||
|---|---|---|---|---|---|
| Объем мишени |
% доза на вовлеченное легкое |
% доза на здоровое легкое |
% доза на сердце |
% доза на пищевод |
% доза на спинной мозг |
| <500 см3 VMAT |
21-36 |
4-25 |
1-24 |
10-57 |
3-15 |
| >500 см3 VMAT |
33-44 |
4-27 |
4-43 |
44-76 |
14-23 |
Использование устройства активного контроля за дыханием позволяет при глубоком вдохе и задержке дыхания увеличить объём лёгкого, тем самым существенно сократив объём облученной здоровой ткани лёгкого, уменьшить клинические отступы (CTV), снизить лучевые реакции, увеличив суммарную очаговую дозу за курс лечения, и значительно увеличить эффективность локального контроля над опухолью [13, 15, 17, 20-22]. Использование одинаковых подходов при выполнении совмещения изображения МСКТ и системы визуализации на ускорителе при активном контроле над дыханием позволяет значительно снизить процент системной ошибки при укладке, увеличивая её воспроизводимость. Из недостатков данной системы надо отметить более длительную предлучевую подготовку пациента. Само облучение также занимает большее количество времени, снижая пропускную способность. Обязательна высокая квалификация персонала.
Среднее время наблюдения составило 12 мес. Отмечено, что у 66% больных признаки прогрессирования заболевания отсутствуют. У 15% через 18+3 нед. выявлены рецидивы заболевания, потребовавшие системной полихимотерапии. У 12% констатировано метастатическое поражение противоположного легкого, потребовавшее повторного лучевого лечения. О 5% пациентов (иногородние жители) информация отсутствует, однако летальных исходов на фоне быстрого прогрессирования заболевания не было. Со стороны сердечно-сосудистой системы признаков миокардита, экссудативного перикардита по данным промежуточного обследования не выявлено. Требуется продолжить дальнейшее наблюдение за данной категорией пациентов.
ЗАКЛЮЧЕНИЕ
Наличие сопутствующей конкурирующей патологии сердечно-сосудистой системы является важным прогностическим фактором при местнораспространенном раке лёгкого. Использование системы активного контроля дыхания и облучения с использованием методики VMAT дает очевидное преимущество у пациентов с объёмом образования менее 500 см3. При активной управляемой задержке дыхания увеличивается общий объём лёгких, сокращается объём PTV, снижается средняя токсичная доза на здоровую ткань легкого, а также на средостение, пищевод, спинной мозг, увеличивается суммарная поглощенная доза, что ведет к значительному увеличению локального контроля над опухолью, снижению лучевой нагрузки на сердце, увеличению безрецидивной выживаемости пациентов.
ЛИТЕРАТУРА / REFERENCES
- Дарьялова С.Л., Бойко А.В., Черниченко А.В. Современные возможности лучевой терапии злокачественных опухолей. Рос. онкол. журн. 2000; 1: 48–55.
- Корытников К.И., Эттингер Т.С., Проскурина Т.В. Изменения сердца, обусловленные отдаленными последствиями лучевой терапии. Клиническая медицина. 1999; 11: 52–55.
- Кутузова А.Б., Лелюк В.Г., Гуськова А.К. Состояние сердца у лиц, подвергшихся воздействию ионизирующего излучения. Медицинская радиология и радиационная безопасность. 2000; 47(3): 66–79.
- Пасов В.В., Зубова Н.Д., Иволгин Е.М. Поздние лучевые повреждения органов грудной клетки. Сибирский онкологический журнал. 2009; 6(36): 58–61.
- Сергоманова Н.Н. Состояние сердечно-сосудистой системы в процессе и после окончания лучевой терапии рака молочной железы. Медицинская радиология. 2009; 2: 39–44.
- Чисов В.И. Онкология: Национальное руководство. М.: ГЭОТАР-Мед. 2008; 128–168.
- Bezjak A. et al. Seamless phase I/II study of stereotactic lung radiotherapy(SBRT) for early stage, centrally located. RTOG0813. 2009; 68–80.
- Abratt R.P., Bogart J.A., Hunter A. Hypofractionated irradiation for non-small cell lung cancer. Lung. Cancer. 2002; 36: 225–233.
- Burman C., Kutcher G.J., Emami B., Goitein M. Fitting of normal tissue tolerance data to an analytic function. Int. J. Radiat. Oncol. Biol. Phys. 1991; 21: 123–135.
- Charlson M.E., Pompei P., Ales K.L., MacKenzie C.R. A new method of classifying prognostic co morbidity in longitudinal studies: development and validation. J. Chronic. Dis. 1987; 40: 373–383.
- De Jaeger K., Hoogeman M.S., Engelsman M. et al. Incorporating an improved dose-calculation algorithm in conformal radiotherapy of lung cancer: reevaluation of dose in normal lung tissue. Radiother. Oncol. 2003; 69: 1–10.
- Engelsman M., Damen E.M., De Jaeger K, van Ingen K.M., Mijnheer B.J. The effect of breathing and set-up errors on the cumulative dose to a lung tumor. Radiother. Oncol. 2001; 60: 95–105.
- Fenwick J.D., Nahum A.E., Malik Z.I. et al. Escalation and intensification of radiotherapy for Stage III non-small cell lung cancer: opportunities for treatment improvement. Clin. Oncol. 2009. doi:10.1016/j.clon.2008.12.01.
- Eriksson F., Gagliardi G., Liedberg A. Long-term cardiac mortality following radiation therapy for Hodgkin s disease: analysis with the relative seriality model. Radiother. Oncol. 2000; 55(2): 153–162.
- Jeremic B., Luther W. et al. Advances in Radiation Oncology in Lung Cancer. Radiation Oncology, Second Edition, 2011.
- Hurkmans C.W., Borger J.H., Bos L.J. Cardiac and lung complication probabilities after breast cancer irradiation. Radiother. Oncol. 2000; 55(2): 145–151.
- Kong F.M., Ten Haken R.K., Schipper M.J. et al. High-dose radiation improved local tumor control and overall survival in patients with inoperable/unrespectable non-small-cell lung cancer: long-term results of a radiation dose escalation study. Int. J. Radiat. Oncol. Biol. Phys. 2005; 63: 324–333.
- Kwa S.L., Lebesque J.V., Theuws J.C. et al. Radiation pneumonitis as a function of mean lung dose: an analysis of pooled data of 540 patients. Int. J. Radiat. Oncol. Biol. Phys. 1998; 42: 1–9.
- Moro-Sibilot D., Aubert A. et al. Comorbidity and KPS are independent prognostic factors in stage I Non-smol-cell lung cancer. Eur. Resp. J. 2005; 480–486.
- Oetzel D., Schraube P., Hensley F., Sroka-Perez G., Menke M., Flentje M. Estimation of pneumonitis risk in three-dimensional treatment planning using dose–volume histogram analysis. Int. J. Radiat. Oncol. Biol. Phys. 1995; 33: 455–460.
- Panakis N., McNair H.A., Christian J.A. et al. Defining the margins in the radical radiotherapy of non-small cell lung cancer (NSCLC) with active breathing control (ABC) and the effect on physical lung parameters. Radiother. Oncol. 2008; 87: 65–73.
- Rodrigues G., Lock M., D’Souza D., Yu E., Van Dyk. J. Prediction of radiation pneumonitis by dose – volume histogram parameters in lung cancer–a systematic review. Radiother. Oncol. 2004; 71: 127–138.
- Theuws J.C., Kwa S.L., Wagenaar A.C. et al. Dose-effect relations for early local pulmonary injury after irradiation for malignant lymphoma and breast cancer. Radiother. Oncol. 1998; 48: 33–43.
- van Baardwijk A., Bosmans G., Bentzen S.M. et al. Radiation dose prescription for non-small-cell lung cancer according to normal tissue dose constraints: an in silico clinical trial. Int. J. Radiat. Oncol. Biol. Phys. 2008; 71: 1103–1110.
- Yorke E.D., Jackson A., Rosenzweig K.E. et al. Dose–volume factors contributing to the incidence of radiation pneumonitis in non-small-cell lung cancer patients treated with threedimensional conformal radiation therapy. Int. J. Radiat. Oncol. Biol. Phys. 2002; 54: 329–339.
- Zhao L., West B.T., Hayman J.A., Lyons S., Cease K., Kong F.M. High radiation dose may reduce the negative effect of large gross tumor volume in patients with medically inoperable early-stage non-small cell lung cancer. Int. J. Radiat. Oncol. Biol. Phys. 2007; 68: 103–110.

Запишитесь на профилактический прием и получите ответ на волнующие вас вопросы о состоянии вашего здоровья.
Получить консультацию можно по номеру +7 (495) 153-49-30