0
0

Конформная высокодозная лучевая терапия метастатических опухолей легкого
№ 5 - 2012 г.
14.00.00 медицинские и фармацевтические науки
УДК 616.24-006:615.846
О.Ю. Аникеева
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина» Минздравсоцразвития РФ (г. Новосибирск) ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздравсоцразвития (г. Новосибирск)
Пролечено 18 пациентов с метастазами в лѐгкое со средним размером опухоли 3,5 см, проведена стереотаксическая лучевая терапия с активным контролем по дыханию методикой ротационного облучения с модуляцией по интенсивности (VMAT). Общая безрецидивная выживаемость при среднем сроке наблюдения 11,7 мес (3–8 мес), составила 78 %, для метастатических опухолей легкого локальный контроль получен 92 % случаев. Отдаленное прогрессирование с медианой 4 мес (диапазон 1–18 мес) от начала радиохирургии отмечено у пяти (33 %) больных. Данное исследование показало, что применение высокодозной гипофракционной стереотаксической лучевой терапии (SBRT) является безопасным и эффективным при лечении метастатических опухолей лѐгкого.
Ключевые слова: высокодозное гипофракционирование; стереотаксическая конформная лучевая терапия; рак легкого; активный контроль дыхания пациента.
Авторы научной публикации
Аникеева Ольга Юрьевна — кандидат медицинских наук, заведующая отделением радиотерапии ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения имени академика Е.Н. Мешалкина», ассистент кафедры онкологии ГБОУ ВПО «Новосибирский государственный медицинский университет», рабочий телефон: 8 (383) 333-14-70, e-mail: o_anikeeva@nricp.ru
Исходные данные исследования
Введение. Легкие занимают 1–2 место по частоте поражения метастатическими (вторичными) опухолями. Это объясняется наличием в легких обширной и разветвленной сети капилляров (мелких сосудов) и тем, что легкое — первый орган, через который проходит венозная кровь после впадения в вены наиболее крупных лимфатических сосудов [1, 2]. Частота и характер метастазирования зависят, как правило, от первичной локализации опухоли. Изолированное метастатическое поражение легких встречается в 6– 30 % случаев. Примерно у 1/3 больных с изолированным поражением легких наблюдаются единичные метастазы, которые в 70–90 % случаев располагаются на периферии легких и потому могут подвергаться хирургическому или комбинированному лечению. Современные подходы к лечению, в том числе лучевая терапия и радиохирургия позволяют добиться у части больных не только положительного эффекта, но и длительной ремиссии [7]. Таким образом, наличие метастазов в легкие не является основанием суждения об инкурабельности (неизлечимости) больного. Периферическая легочная ткань, согласно радиобиологической модели, имеет параллельную архитектуру, к ней можно подвести высокую дозу облучения без чрезмерного риска лучевого пульмонита при условии, что достаточный объем нормальной ткани легкого не подвергался облучению [6].
Метод официально протестировали в исследовании повышения дозы, включавшем больных с неоперабельным немелкоклеточным раком легкого (НМРЛ) I стадии [4,6]. Врачи из Университета Индианы сообщают, что максимальной переносимой дозой является 66 Гр, подведенные за 3 фракции. Во II фазе исследования экстракраниальной стереотаксической лучевой терапии (ЭСЛТ) в дозе 60–66 Гр за 3 фракции позволила добиться актуарного 2-летнего контроля, равного 95 % [4, 10]. Сходные результаты получены в других исследованиях с применением высоких доз ЭСЛТ у больных НМРЛ I стадии [4, 6, 10]. Исследователи наблюдали зависимость ответа от дозы: с повышением дозы локальный контроль (ЛК) улучшался.
Целью исследования была оценка эффективности и переносимости высокодозной стереотаксической лучевой терапии при лечении больных с единичным метастазом в лѐгкие.
Материалы и методы. Данные представлены 18-ю пациентами (13 мужчин и 5 женщин в возрасте 54–77 лет (медиана возраста — 62,7 года)), которым проводилось нестандартная гипофракционная стереотаксическая конформная дистанционная лучевая терапия по поводу единичных метастазов в легкое, получивших лечение в отделении радиотерапии ННИИПК им. академика Е.Н. Мешалкина в период с октября 2010 по май 2012 года. Распределение больных и характеристики вторичных метастатических очагов представлены в табл. 1.
Группировка пациентов
Таблица 1
Распределение больных и характеристики вторичных метастатических очагов
| Характеристика пациентов |
Количество больных (n = 18) |
|---|---|
| Мужчин |
10 (55,5 %) |
| Женщин |
8 (44,5 %) |
| Медиана возраста |
62,7 лет |
| Общесоматический статус |
|
| ECOG WHO |
1 — 5 %, 2 — 37 %, 3 — 58 % |
| Курение |
|
| Никогда не курили |
4 (15 %) |
| Курение в анамнезе |
17 (63 %) |
| Курение постоянно |
5 (22 %) |
| Коморбидность |
98% |
| орфологические варианты |
|
| Плоскоклеточный рак |
3 (16,6 %) |
| Аденокарцинома: |
14 (77,7 %) |
| — высокодифференцированная |
1 |
| — умереннодифференцированная |
7 |
| — низкодифференцированная |
5 |
| — недифференцированная |
1 |
| Саркома светлоклеточная |
1 (5,55 %) |
| Рак толстого кишечника |
5 (27,7 %) |
| Рак молочной железы |
6 (33,3 %) |
| Рак лѐгкого |
4 (22,2 %) |
| Рак яичников |
2 (11,1 %) |
| Саркома матки |
1 (5,5 %) |
Критерии включения в исследование: взрослые больные с одним метастазом в легкое любой первичной опухоли за исключением лейкозов и лимфом; максимальный общий диаметр опухолей менее 7 см; отсутствие лучевой терапии (ЛТ) легких в анамнезе; адекватная функция легких (стабильное насыщение гемоглобина артериальной крови более 90 % при минимальной физической нагрузке, объем форсированного выдоха за первую секунду (ОФВ1) более 40 % от расчетного или более 1 л, диффузионная способность легких более 40 % от расчетной); отсутствие системного лечения в течение 14 дней до и после ЭСЛТ; допускалось наличие опухоли вне легких при условии небольшого ее размера и выполнимости хирургического лечения, общее состояние по шкале Карновского не менее 70 %. Все пациенты подписали информированное согласие на участие в исследовании.
Выключение из исследования — прогрессирование заболевания, угроза кровотечения, выраженные лучевые реакции (гипертермия, снижение показателей ростков крови ниже II степени агранулоцитоза), отсутствие воспроизводимости укладки с учѐтом недостаточной толерантности к методике ABC, стандартные противопоказания к проведению лучевой терапии.
Показатель динамики облучаемого объѐма оценивался после выполнения контрольной МСКТ с контрастированием через каждые 3, 6, 12 месяцев или в случае ухудшения по показаниям, в течение всего периода наблюдения. Средняя медиана наблюдения составила 12 месяцев. Локальный контроль (ЛК) оценивали независимо от отдаленного прогрессирования. Причиной выбора срока наблюдения 6 мес для определения ЛК послужило желание избежать неточностей, связанных с ранними преходящими радиологическими и метаболическими изменениями в области, получившей высокую дозу [3, 5, 8]. У больных, умерших в первые 6 мес после ЛТ, ЛК не оценивали, но анализировали побочные эффекты и общую выживаемость.
Проведение исследования
На этапе предлучевой подготовки было выполнено МСКТ с серией исследований при помощи системы ABC [9]. Оконтуривание и совмещение изображений проводилось на станции оконтуривания Focal Pro, расчѐт лечебного плана — на планирующей системе Ergo++. GTV были очерчены согласно данных визуализации и предложенных атласов RTOG. В данной группе использовались стандартные рекомендованные отступы для CTV = 1,0 см вверх и вниз и 1,0 в аксиальной плоскости. PTV соответственно составили в верхней и средней доле — 0,5 см superior/inferior, в нижней доле — 0,7 см superior/inferior, anterior/posterior = 0,5 см, left/right = 0,5 см для всех долей. Эти отступы были просчитаны в результате совмещения двух серий изображений МСКТ на свободном дыхании и при МСКТ при использовании ABC устройства. Было определено среднее значение подвижности лѐгкого на фоне ABC. Облучение проводилось инновационной методикой VMAT (Volumetric Modulated Arc Therapy) — ротационное объемно-модулированное облучение. Наличие системы контроля по изображению (IGRT) позволяло контролировать точность установки и воспроизведения укладок. Средняя суммарная очаговая доза (СОД) составила 48–60 Гр, количество фракций зависело от режима фракционирования, разовая очаговая доза за фракцию (РОД) была в диапазоне от 15–20 Гр с покрытием 95 % изодозой объѐма GTV. Такое колебание разовой очаговой дозы было связано в первую очередь с объѐмом опухолевого субстрата, а также близости органов риска. В охвате PTV стремились к максимально идентичным и сопоставимым планам в какой мере это было возможно. Нагрузка на критические органы (средостение, спинной мозг, пищевод, противоположное легкое, печень) были сделаны с учѐтом толерантности здоровых тканей. Сеансы лучевой терапии проводились, как правило, через день, в отдельных случаях при имеющихся признаках токсичности лучевой терапии облучение проводилось через 3–5 дней.
Результаты исследования
Результаты. Оценка локального ответа после лучевого лечения была проведена в 16-ти наблюдениях после исключения больных, у которых отсутствовали данные контрольных МСКТ и результаты их лечения оценивались только по данным рентгенографии лѐгких и общей выживаемости.
Показатели общей регрессии (полной, частичной, минимальной и стабилизации процесса) первичного очага по данным МСКТ легких составила 92 %. (табл. 2).
Таблица 2
Параметры лучевой терапии
| Показатель |
Абс/% |
|---|---|
| Локализация опухоли |
|
| Периферийные локализации |
15 (90 %) |
| Центральные локализации |
3 (10 %) |
| Средний размер опухоли |
33 ± 9 мм |
| Средний объѐм опухоли |
14,2 см3 (4,27–74 см3) |
| Технология облучения |
|
| VMAT/IMRT |
17 (94 %) / 1 (6 %) |
| Средняя доза облучения (BED) |
|
| 48 Гр/3 Фр (105,6 Гр) |
2 (11,1 %) |
| 54 Гр/3 Фр (151,2 Гр) |
10 (55,5 %) |
| 60 Гр/3 Фр (150 Гр) |
2 (11,1 %) |
| 20 Гр/1 Фр (60 Гр) |
4 (22,2 %) |
Примечание: VMAT (Volumetric Modulated Arc Therapy) — ротационное объемно-модулированное облучение; IMRT (Intensive Modulated Radiotherapy) — модулированная по интенсивности лучевая терапия; BED (biological effective dose) — биологически эффективная доза.
Общая безрецидивная выживаемость при среднем сроке наблюдения 11,7 мес (3–18 мес), составила 78 %, для метастатических опухолей легкого локальный контроль получен в 92 %. Отдаленное прогрессирование с медианой 4 мес (диапазон 1–18 мес) от начала SBRS отмечено у пяти (27,7 %) больных. Первым проявлением прогрессирования у четырех больных были отдаленные метастазы, а у одного — местный рецидив. Общую выживаемость не оценивали, поскольку наблюдение за данной группой пациентов продолжается. МСКТ контроль показал полную нивелировку очага (у двух пациентов, частичное — для 12-ти, стабильное — для двух пациентов, прогрессирование — для двух пациентов). Умерли к концу наблюдения 4 пациента, двое от прогрессирования заболевания (1 — регионарный рецидив, 1 — множественные очаги в печени, обнаруженные по данным МСКТ брюшной полости через 8 месяцев после облучения). 1 пациент — от повторного инфаркта миокарда через 6 месяцев после облучения. 1 пациент — на фоне генерализации процесса колоректального рака, остальным потребовалось продолжение системной полихимиотерапии по поводу основного злокачественного заболевания. В одном случае пациентка с распространенным злокачественным заболеванием молочной железы при стабилизации метастатического процесса в легком более 12 мес после проведенного лечения поступила на повторный курс радиохирургии по поводу МТС очагов в головной мозг. Осложнений, связанных с облучением по шкале RTOG 3–5 стадии, не было. Не было случаев лейкопении, лучевого эзофагита, медиастинита или клинически видимого острого лучевого пневмонита. Поздние лучевые осложнения IIst., согласно шкале (LENT SOMA, 1995), были выявлены у одного пациента (5,5 %). Это доказывает, что данная методика оказывает эффективный локальный контроль над опухолью с минимальной токсичностью, тем самым демонстрируя результаты, сопоставимые с хирургическим вмешательством. Уровень локальной прогрессии составил, по мнению авторов, не более 6–10 %, при чем риск локальных рецидивов возникал в той группе, где разовая очаговая доза не превышала 10 Гр за фракцию. Тем не менее, объѐм образования, превышающий 12 см3, увеличивает риски токсичности. В грудной клетке чувствительными структурами являются рядом лежащее легкое, пищевод, спинальный мозг и сердце. Низкая лучевая толерантность этих структур ограничивает общую дозу облучения этих пациентов. На рис. показан пример пациентки К., 57 лет.
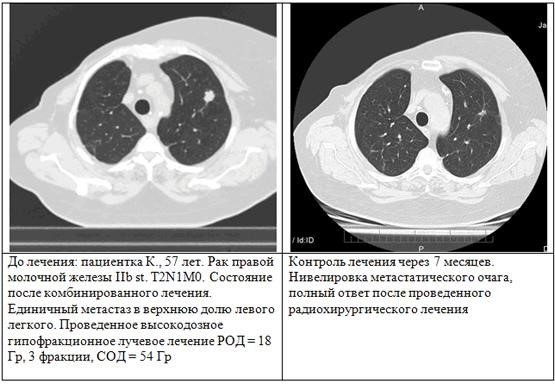
Пример характерного пациента
Итоги исследования
Заключение. Высокодозная гипофракционная стереотаксическая лучевая терапия(SBRT) является безопасным и выполнимым для лечения метастатических опухолей лѐгкого.
В дополнительных исследованиях планируется изучить оптимальную дозу, лучшую технику компенсации движения, а также оценить преимущества и недостатки лечения различными режимами облучения.
Список литературы
- Пасов В. В. Поздние лучевые повреждения органов грудной клетки / В. В. Пасов, Н. Д. Зубова, Е. М. Иволгин // Сиб. онкол. журн. — 2009. — № 6. — С. 58–61.
- Чисов В. И. Онкология: национальное руководство / В. И. Чисов. — М. : ГЭОТАР-Медиа, 2008.
- A phase I/II trial of stereotactic body radiation therapy (SBRT) for lung metastases: Initial report of dose escalation and early toxicity / T. E. Schefter [et al.] // Int. J. Radiat. Oncol. Biol. Phys. — 2006. — N 66. — Р. 120–127.
- Early results of CyberKnife image-guided robotic stereotactic radiosurgery for treatment of lung tumors / W. T. Brown [et al.] // Comput. Aided. Surg. — 2007. — N 12 (5). — Р. 253–261.
- Excessive toxicity when treating central tumors in a phase II study of stereotactic body radiation therapy for medically inoperable early-stage lung cancer / R. Timmerman [et al.] // J. Clin. Oncol. — 2006. — N 24. — Р. 4833–4839.
- Extracranial stereotactic radiotherapy for lung metastases : Phase I / II st of the RTOG trial / D. Brian [et al.] // J. of Сlinical Oncology. — 2009. — N 10. — Р. 201–206.
- Hypofractionated irradiation for non-small cell lung cancer / R. P. Abratt [et al.] // Lung cancer. — 2002. — N 36. — Р. 225–233.
- Incorporating an improved dose-calculation algorithm in conformal radiotherapy of lung cancer : revaluation of dose in normal lung tissue / K. De Jaeger [et al.] // Radiother. Oncol. — 2003. — N 69. — Р. 1–10.
- Reduction of organ motion in lung tumors with respiratory gating / Р. Giraud [et al.] // Lung. Cancer. — 2006. — N 51 (1). — Р. 41–51.
- Review of Hypofractionated Small Volume Radiotherapy for Early-stage Non-small Cell Lung Cancer / Brock [et al.] // Clinical Oncology. — 2008. — N 20 (9). — Р. 666–676.

Запишитесь на профилактический прием и получите ответ на волнующие вас вопросы о состоянии вашего здоровья.
Получить консультацию можно по номеру +7 (495) 153-49-30